| |
Este é um projeto em construção permanente. O
texto de abertura é de caráter jornalístico, ao
qual serão anexados hipertextos explicativos
{E}, de complementação científica {C}, de
interesse médico {M}, portais relacionados ao
assunto {P} e explicação de alguns termos que
estão em nosso Dicionário de DOR {D}.
Gostaríamos que você, nosso leitor, nos desse
sugestões para facilitar a compreensão dos
textos, enviando-nos informações, pontos a serem
acrescentados e comentários ou ilustrações, que
poderão ser inseridos ao texto ou anexados como
hipertextos.
|
 |
|
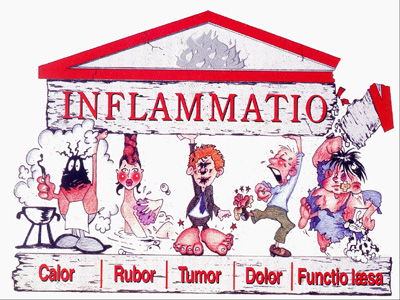
Figura 1: O Templo da Inflamação |
|
Será que, como alguns santos,
os cientistas fazem milagres? Muita gente
gostaria de ouvir “dor nunca mais...”, mas por
acaso os cientistas pretendem abolir todas as
dores? Será que o homem precisa da dor? A dor é
a percepção de uma experiência sensorial
nociceptiva (noceo = nocivo), com conotação
(tonalidade) afetiva aversiva e desagradável,
oposta ao prazer. Mas não foi somente o prazer
(ou a ausência dele) que garantiu o
desenvolvimento e a sobrevivência de nossa
espécie. É sempre necessária uma estimulação
sensorial forte quando a nossa sobrevivência
corre perigo. É preciso um sinal que dê a
percepção de que algo está errado na relação
entre o indivíduo e o ambiente ou algo de
anormal está ocorrendo em seu corpo. Esta
percepção de “algo errado” foi selecionada por
milhões de anos durante a evolução das espécies.
O desafio sempre foi sobreviver quando as
condições externas favoreciam o nosso
desaparecimento. Pelos acasos evolutivos, sem a
Natureza dar saltos, os seres vivos presentes
neste nosso planeta desenvolveram mecanismos de
auto-proteção contra estímulos ambientais
nocivos. A nocicepção (percepção do que causa
dano) certamente foi fundamental para que os
animais aprendessem a viver e sobreviver em um
ambiente inóspito. É clássico o exemplo de
crianças que, por defeito genético, não sentem
dor, tendo uma vida extremamente problemática,
morrendo precocemente.
O homem sempre conviveu com a
dor, mas também sempre tentou dominá-la. Se é
óbvia a contribuição das dores agudas para a
sobrevivência, é difícil apontar um papel
evolucionário positivo para as dores crônicas.
De uma forma simplificada
existem dois diferentes tipos de dor aguda:
aquele que está relacionado com o ambiente (alo-nocicepção,
alo = fora) e aquele relacionado com a percepção
de ocorrências em seu próprio organismo (proprio-nocicepção,
proprius = de si).
Os mecanismos nervosos
selecionados para a nocicepção ambiental
envolvem uma transmissão neuronal do estímulo
muito rápida (±120 m/s, ± 450 km/h) quando
comparados com os sistemas que transmitem os
estímulos proprio-nociceptivos originários de um
tecido injuriado (± 0,4 m/s, ± 1,5 km/h). O
calor ou o frio intenso, ou mesmo a picada de
uma agulha, é rapidamente detectado e
reconhecido pelo organismo, que se protege do
estímulo nocivo. Como já mencionado
anteriormente, a ausência destas respostas
poderia levar a uma lesão que colocaria em
cheque a vida do indivíduo.
Nós vivemos, todavia, em um
ambiente cujas agressões podem ser menos
dramáticas, mais lentas, porém não menos
perigosas. Uma bactéria ou um vírus entra
sorrateiramente em um tecido e se reproduz
lentamente levando a uma inflamação infecciosa
aguda. Uma outra situação, mais irreverente
(talvez um erro em nossa evolução), é quando o
nosso organismo fabrica substâncias contra
nossos próprios tecidos, como, por exemplo, os
anticorpos responsáveis pelas doenças
auto-imunes (artrite reumatóide). O resultado,
neste caso, é uma resposta inflamatória em
várias articulações.
Uma inflamação pode ser
resolvida por mecanismos biológicos ou com a
utilização da terapêutica medicamentosa. Esta
inflamação aguda, entretanto, pode persistir e
cronificar-se. Uma inflamação persistente ou
recidivante (crônica com períodos de agudização)
pode levar à destruição permanente dos tecidos.
Freqüentemente estes processos são dolorosos e
de difícil controle.
|
 |
|
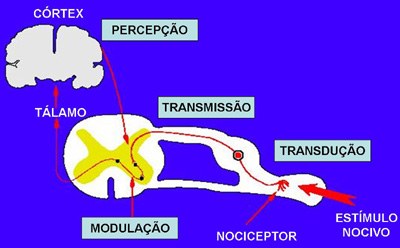
Figura 2:
Caminhos da Dor (SNC) |
|
Uma resposta tecidual
inflamatória aguda é caracterizada pelos famosos
sinais cardinais: rubor, calor, tumor e dor.
Pense numa espinha nascendo no rosto, ou nas
costas esbeltas de uma banhista que se esqueceu
ao sol. Aproxime a mão vagarosamente da pele
avermelhada (rubor) e sua mão perceberá que ela
está levemente mais quente do que a sua pele
normal. Agora seja chato! Dê uma cotucadinha na
espinha ou uma palmadinha nas sinuosidades da
amiga. Mas cuidado! Você sabe que após uma fraca
queimadura de sol, basta um chuveiro morno para
causar dor (nocicepção inflamatória). É que um
tecido inflamado fica muito mais sensível a
estímulos que normalmente não produzem ou
produzem pouca dor. Este fenômeno é
característico da dor inflamatória e é devido à
sensibilização dos neurônios nociceptivos. A
figura acima dá uma informação enganosa. A dor
inflamatória não ocorre imediatamente após ou
durante o estímulo nocivo. A sensibilização dos
nociceptores ocorre pela ativação da “cascata de
citocinas”, que necessita de tempo para se
instalar, pois é decorrente de processos
metabólicos neuronais.
Assim como temos um sistema
neurológico para conduzir as sensações visuais e
auditivas da periferia ao cérebro, as sensações
dolorosas (nocicepção) também têm um complexo
sistema de transmissão. Neste sistema há
mecanismos que amplificam ou inibem, no neurônio
periférico, a entrada do estímulo doloroso. Há
também mecanismos centrais associados à
definição da qualidade e aprendizado da dor,
isto é, da percepção e descrição da dor (vide
abaixo). Embora os neurônios centrais possam
amplificar ou diminuir os sinais “dolorosos”, o
neurônio primário nociceptivo tem um papel
fundamental na dor inflamatória. Uma vez
estimulado, eles geram e conduzem o estímulo
para a medula espinal, passando por vários
caminhos até chegar a algumas áreas do córtex
cerebral, onde a sensação nociceptiva é
detectada e analisada (processo de percepção). O
neurônio sensitivo primário faz a sua primeira
sinapse em regiões bem definidas (lâminas de
Rexel) no corno posterior da medula. Hoje,
sabe-se que entre um neurônio e outro existe uma
fenda, desta forma o sinal neuronal tem que
“saltar” de um neurônio para o outro através da
chamada fenda sináptica. Raramente há condução
elétrica entre um neurônio e outro. A
transmissão na sinapse se dá através da
liberação, pelo terminal nervoso (dendrito), de
substâncias (mediadores primários e
intermediários) que atuam nos receptores do
axônio do neurônio subseqüente. Entre os
mediadores mais importantes na medula espinal
estão o glutamato e as prostaglandinas.
Atualmente, a consciência da
experiência de sensação da dor é entendida como
uma função cortical. O impulso nervoso sobe pela
medula e atinge a parte basal do cérebro, onde
faz a segunda sinapse (relê talâmico). Os sinais
podem se dirigir diretamente para o córtex
(parietal anterior) ou estimularem o sistema
nervoso neuro-vegetativo (produção de sudorese,
aumento de pressão sanguínea e freqüência
cardíaca etc). Os estímulos nociceptivos também
se dirigem para o sistema límbico (amígdala),
que define a tonalidade afetiva da dor e é um
dos sítios de ação da morfina. Neste local você
tem a sensação mas não tem a percepção da dor:
“a dor não dói”. O estímulo finalmente atinge a
área parietal posterior, onde acontece a
integração da rede neuronal nociceptiva,
ocorrendo, então, a percepção (interpretação) da
dor.
Os estudos contemporâneos que
permitem definir a localização e o momento de
chegada dos estímulos no córtex baseiam-se na
avaliação regional do fluxo sangüíneo ou do
incremento do metabolismo (aumento de consumo de
glicose ou atividade oxidativa) pelas células
cerebrais, utilizando o PET (Tomografia por
Emissão de Pósitron) e fMRI (Imagens Funcionais
por Ressonância Magnética). Estes métodos
detectam dor aguda, porém não detectam dor
espontânea referida pelo paciente (ongoing pain).
Todavia, detectam a presença de distúrbios
neuro-funcionais de redes neuronais, associados
à dor crônica (p.ex., dor neuropática).
Estímulos nociceptivos constantes produzem
imagens de intensidade variável em diferentes
indivíduos, mas com uma ordenada distribuição
temporal entre as áreas corticais. Há um retardo
dos sinais entre as áreas de detecção do
estímulo doloroso e aquelas relacionadas com sua
percepção (consciência).
Os animais sentem dor? Como a
dor envolve uma atividade subjetiva (percepção)
e capacidade verbal de descrição, não temos a
possibilidade de saber se os animais sentem dor.
Eles apresentam respostas fisiológicas ou
comportamentais frente a estímulos que inferimos
serem semelhantes à dor humana. Assumimos que
tais respostas são devido a uma sensação
nociceptiva desencadeada pelos estímulos
detectados e transmitidos pelo sistema nervoso
nociceptivo do animal. O grande argumento de que
esta hipótese é correta e relevante vem da
observação científica de que drogas analgésicas
no homem são antinociceptivas nos animais. Da
mesma maneira, drogas que são antinociceptivas
nos animais, freqüentemente são analgésicas no
homem.
|
 |
|
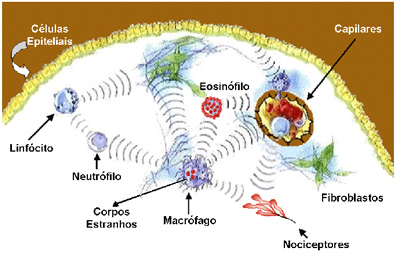
Figura 3: Cenário Inflamatório
Citocinas –
conversação entre as células |
|
As dores proprio-nociceptivas
podem ter três origens em nosso organismo: a) de
um tecido inflamado (dor inflamatória); b)
devido a uma disfunção fisiológica em um órgão
(dor visceral, p. ex. cólicas) ou c) em um nervo
(dor neuropática). A dor neuropática ocorre em
um nervo permanentemente lesado por um trauma
físico, biológico, inflamatório ou infeccioso
(p.ex. a dor que ocorre após uma infecção
intensa por herpes, a chamada “dor do nervo
trigêmio”).
Um estímulo nocivo externo ou
um “corpo estranho” detectado pelo tecido pode
causar uma injúria tecidual. Nestas
circunstâncias ocorre uma inflamação. Durante o
processo inflamatório há mudanças no cenário
celular, com o surgimento de células de
“defesa”. Estas mudanças são conseqüências da
conversação (química) entre as várias células
locais. Os mediadores desta conversa, chamados
citocinas e quimiocinas, são liberados em
seqüência, em forma de cascata.
As substâncias liberadas pelo
desencadear do processo inflamatório promovem a
sensibilização do nociceptor permitindo, assim,
que o estímulo ative o nociceptor do neurônio
inflamatório periférico.
Podemos, de forma
simplificada, usar o funcionamento de uma
campainha (ou a buzina de um carro) para
ilustrar algumas características dos vários
tipos de neurônios primários nociceptivos.
|
 |
|
Figura 4: Esquema Geral |
|
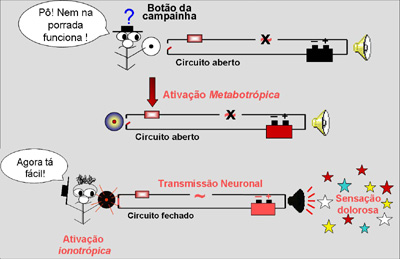
O soar da campainha seria o
“transmitir a dor” e o botão da campainha
representaria os receptores localizados na
membrana dos neurônios sensitivos primários (nociceptores
distribuídos por todas as vísceras e tecidos do
organismo). Uma campainha é energizada
eletricamente (bateria neste caso) e o botão
simplesmente interrompe a corrente.
Quando se aperta o botão, o
circuito fecha (eletrifica o circuito) e a
campainha toca. Isto é, quando o nociceptor é
ativado, gera localmente um potencial de ação
que se transmite pelo neurônio até a medula,
onde o sinal é transferido para o segundo
neurônio.
|
 |
|
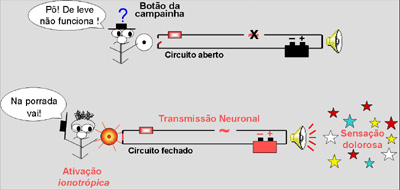
Figura 5: Alo-Nocicepção
Receptor mecano-termo-sensitivo, Polimodal de Alto Limiar (PMAL) |
|
Os nociceptores para detecção
de estímulos ambientais obviamente se apresentam
em maior número na pele. As vias nervosas da
nocicepção ambiental (alo-nocicepção),
semelhantemente às campainhas, já estão
energizadas (bateria pronta). Basta um toque
para que a campainha soe, porém, o botão desta
campainha é duro de apertar (nociceptores de
alto limiar). Na inflamação ocorre sua
sensibilização (hiperalgesia, alodinia ou
hipernocicepção). Nestas condições, um estímulo
que era pouco ou inefetivo passa a ser doloroso.
Há um grupo de receptores que
parecem ser os mais relevantes para a dor
inflamatória. São os chamados de receptores
silenciosos ou dormentes (sleeping
nociceptors), que representam 30% dos
nociceptores da pele. Estes não são ativados
mesmo com um estímulo forte, necessitando serem
previamente sensibilizados para sua ativação.
Para a campainha inflamatória
tocar, é necessário ativar a bateria (daí,
então, o botão pode fechar o circuito e tocar a
campainha). Os neurônios nociceptivos
inflamatórios primários (NNIP) estão
“afuncionais” ou com limiar muito alto (o botão
da campainha é duro de apertar!).
|
 |
|
Figura 6:
Silenciosos ou PMAL |
|
Os mediadores secundários ou
segundos mensageiros – presentes no interior da
célula neuronal – são responsáveis pela
fosforilação de canais localizados na membrana
celular, tornando os nociceptores funcionais.
No estado sensibilizado dos
NNIP, os mediadores ionotrópicos, presentes no
local da inflamação, conseguem ativar os
nociceptores mesmo em pequenas quantidades. Mas,
talvez mais importantes que os mediadores, são
os estímulos mecânicos, que em condições normais
não produzem dor e agora são capazes de causá-la
(lembrem-se da espinha no rosto e da queimadura
de sol). Estes mediadores ativadores dos
nociceptores são denominados de mediadores
primários nociceptivos ionotrópicos. São
ionotrópicos porque a geração (potencial
gerador) e a condução (potencial de ação) do
estímulo envolvem fundamentalmente trocas
iônicas, principalmente entre Na +
e K+.
Um estímulo nocivo causa uma
injúria tecidual induzindo mudança do cenário
celular decorrente da liberação de mediadores
inflamatórios, que são basicamente de 3 tipos:
os mediadores nociceptivos “intermediários” (MNI),
os primários (MNP), e os segundos mensageiros ou
secundários (MNS). Os mediadores nociceptivos
“intermediários” (MNI) - citocinas e quimiocinas
- originam se de células locais ou migratórias,
estimulando a liberação de outros mediadores
intermediários ou de mediadores primários.
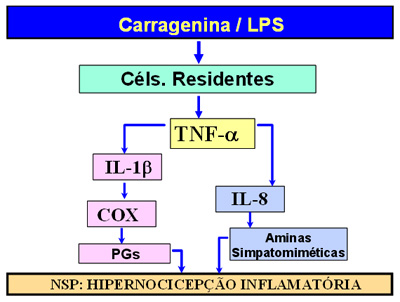
O esquema abaixo ilustra
observações experimentais. Uma inflamação
induzida por uma substância irritante chamada carragenina ou por uma toxina bacteriana (lipopolisacarídeo
– LPS) estimula as células residentes do tecido
a liberarem uma citocina denominada TNF- a
(Fator de Necrose Tumoral) que, por sua vez,
induz a liberação de outras duas citocinas:
interleucina 1-Beta (IL-1b)
e Interleucina-8 (IL-8). A IL-1b
promove a ativação de uma enzima denominada
ciclooxigenase (COX) responsável pela produção
de prostaglandinas. A IL-8 promove a produção
local de aminas simpatomiméticas (p. ex.
dopamina e noradrenalina). As prostaglandinas e
as aminas simpatomiméticas atuam nos receptores
dos neurônios sensitivos primários (NSP)
induzindo a sua sensibilização.
|
 |
|
Figura 7:
Cascata de Citocinas |
|
As substâncias denominadas
glicocorticóides inibem a liberação de várias
citocinas e a ativação das ciclooxigenases, que
são enzimas responsáveis pela liberação de
prostaglandinas. Portanto, os corticóides são
analgésicos por bloquearem a liberação de várias
citocinas hiperalgésicas.
|
 |
|
Figura 8:
Dor inflamatória |
|
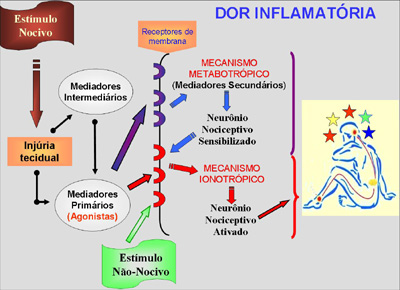
A figura acima sumariza os
conceitos até agora desenvolvidos. Na inflamação
há liberação de mediadores primários que causam
sensibilização de nociceptores ou sua ativação.
Esta sensibilização promovida pelos mediadores
secundários (mecanismo metabotrópico), ocorre
pelo abaixamento do limiar de ativação dos
nociceptores e pela facilitação da condução
neuronal por tornar funcionais uma família de
canais de sódio denominadas
tetrodotoxina-resistentes (TTX-r). Estes canais
parecem ser específicos dos neurônios
nociceptivos inflamatórios. Atualmente estes
canais constituem um dos alvos mais importantes
para o desenvolvimento de analgésicos
(inibidores de canais de sódio TTX-r). A
hipernocicepção (hiperalgesia) é um denominador
comum de todos os processos inflamatórios.
Os analgésicos do tipo da
aspirina funcionam por inibirem a formação de
prostaglandinas. Estes analgésicos são também
chamados de drogas antiinflamatórias
não-esteroidais (AINES), os quais previnem a
sensibilização dos nociceptores. Na inflamação
há duas “prostaglandinas” sensibilizadoras
principais, a PGE2 e a prostaciclina. A
prostaciclina produz uma sensibilização imediata
e de curta duração do NNIP. Ao contrário, quando
a PGE2 estiver presente na inflamação, causará
uma sensibilização demorada. Na dor de cabeça é
possível que a prostaciclina liberada pelo
endotélio seja a substância sensibilizadora.
Nesta eventualidade, o uso de uma droga do tipo
da aspirina tem um efeito rápido. Isto não
ocorre em outras eventualidades. Na dismenorréia
(cólica menstrual), por exemplo, consegue-se
prevenir o desenvolvimento da dor como
tratamento preventivo. Todavia, quando ela já
está estabelecida, o efeito das drogas do tipo
da aspirina não é imediato e somente após
sucessivas administrações alcança-se um efeito
analgésico. Entretanto, administrações
irregulares podem deixar de controlar a dor,
pois pode ocorrer a formação de prostaglandinas
que sensibilizam novamente os NNIP.
Há um grupo de substâncias
que em contra-posição às drogas do tipo da
aspirina são capazes de bloquearem diretamente a
sensibilização dos nociceptores. Estas atuam por
um mecanismo molecular que bloqueia a diminuição
do limiar dos nociceptores, portanto antagoniza
a dor inflamatória. Este é o grupo ao qual
pertence a dipirona (Novalgina ®).
Concluindo, neste texto
discutimos três mecanismos da analgesia
periférica: a) o dos corticóides, que bloqueiam
a cascata de citocinas, b) o dos inibidores da
ciclooxigenase (drogas do tipo da aspirina), que
previnem a sensibilização dos nociceptores, e,
finalmente, c) drogas que inibem diretamente a
sensibilização, como a dipirona.
Talvez no futuro possamos
inventar uma terapia gênica que acabe com os
genes responsáveis pela produção de substâncias
fabricadas pelos tecidos e que são responsáveis
pela dor. O problema é que estas substâncias são
importantes em muitos processos fisiológicos
fundamentais para o nosso organismo, mas a sorte
pode estar do nosso lado em encontrarmos outras
maneiras de controlar a dor.
|

