A dor pode ser
descrita como uma “experiência sensorial, com
tonalidade afetiva desagradável, oposta ao
prazer, induzida por estímulos (nocivos/nociceptivos)
mecânicos, térmicos, químicos, elétricos ou
fisiopatológicos”. A esta sensação (dor/nocicepção)
estão associadas respostas neurovegetativas ou
comportamentais, que são mais intensas ou mais
rápidas quando o tecido está inflamado.
Considerando aspectos comportamentais como
reações no sentido de evitar estímulos
desagradáveis, pode-se dizer, também, que a dor
é um sintoma com finalidade protetora, que
“alerta” a presença de ameaças, protegendo a
integridade física do organismo no ambiente e
defendendo-o contra agentes infecciosos,
“avisando” a ocorrência de distúrbios
patológicos orgânicos por meio dos sistemas
imunes inato e adaptativo.
Entretanto, a
definição do conceito “dor” não é tão fácil, uma
vez que componentes subjetivos próprios do
indivíduo podem alterar a sensação produzida por
estímulos nocivos. Desta forma, é interessante
relacioná-la às vias nervosas especializadas em
detectar a presença de estímulos nocivos, ou que
podem se tornar nocivos caso permaneçam. Tais
vias são conhecidas como vias nociceptivas,
e são compostas por fibras neuronais que são
ativadas por estimulação intensa.
Essa discussão
surgiu do fato de que muitos dos experimentos
realizados com metodologias que empregam
estímulos dolorosos são realizados em animais,
os quais apresentam reações comportamentais
compatíveis com a sensação de dor, porém, uma
vez que não é possível determinar objetivamente
se a sensação apresentada é realmente dor
– já que o animal não pode se comunicar -, é
preferível classificá-la como sendo resultado da
ativação das vias nociceptivas. Portanto,
podemos denominar tais reações em animais
experimentais como nocicepção.
Considerando que a
investigação científica da hipernocicepção e
nocicepção de origem inflamatória pode ser
realizada seguindo vários protocolos, nesta
seção de nosso Portal DOL apresentamos uma breve
descrição dos métodos mais utilizados em
laboratórios para avaliação de comportamentos
apresentados por animais submetidos à
experiência dolorosa (ou nociceptiva, como
explicado acima). É importante salientar que a
utilização destes testes deve estar sempre
condicionada à submissão de seu protocolo ao
Comitê de Ética de cada instituição, para que a
metodologia seja analisada de acordo com normas
internacionais de experimentação animal, e, sua
realização, aprovada. Desta forma, todos os
ensaios mostrados abaixo foram previamente
aprovados pela CETEA - Comissão de Ética em
Experimentação Animal da FMRP, em estudos
relacionados a trabalhos científicos do grupo de
dor e inflamação do Departamento de Farmacologia
da Faculdade de Medicina de Ribeirão Preto.
São apresentados
dois tipos de testes: os que avaliam a ação de
drogas sobre comportamentos indicativos de
dor manifesta (ou nocicepção manisfesta),
nos quais o estímulo utilizado causa, por si só,
a ativação das vias nociceptivas, induzindo o
comportamento compatível com dor (como nos casos
do teste de formalina ou de contorções
abdominais com ácido acético), e os modelos de
avaliação de hipernocicepção, nos quais é feita
a administração de drogas que induzem a
sensibilização das fibras neuronais nociceptivas.
Nestes últimos, são avaliados parâmetros que
indiquem e presença de fenômenos como a
hipernocicepção ou alodinia, ou seja, nos quais
ocorre diminuição do limiar de tolerância à
estimulação de caráter mecânico, térmico ou
químico.
Ainda, ao final de
cada item, apresentamos referências
bibliográficas de trabalhos que abordam tais
metodologias.
1.
Ensaio de contorções abdominais induzidas por
ácido acético 0,1 N
1.1 - Animais
Camundongos ou
ratos.
1.2 - Tipo de teste
Nocicepção
manifesta por injeção de agente algésico.
1.3 - Detalhamento do teste
|
 |
|
Vídeo
1: Demonstrativo do ensaio de
contorções
(arquivo ASF, tamanho aproximado 1,2 MB) |
|
Após a injeção
intraperitoneal (ip) de um agente nociceptivo
em ratos ou camundongos, observa-se respostas
que consistem em uma seqüência de contorções e
extensões do abdômen, algumas vezes
acompanhada por torções do tronco e extensão
dos membros posteriores do animal. Este
comportamento foi denominado de contorção
abdominal por Whittle em 1964.
Para o ensaio
são utilizados camundongos suíços de ambos os
sexos, com peso entre 18 e 25 gramas. Ratos de
pouca idade (100 g) também podem ser
submetidos ao teste. Os animais são mantidos
em jejum por um período de 8 horas. As
substâncias devem ser administradas
preferencialmente por via oral. Trinta minutos
após a administração das drogas a serem
testadas, é feita a injeção do estímulo
algésico, ou seja, injeta-se ácido acético
0,1N na cavidade peritoneal dos animais (0,1
ml/10 g de peso do animal). Dez minutos após
administração do ácido acético inicia-se a
contagem das contorções, durante vinte
minutos.
1.4 - Bibliografia
-
COOLIER,
H.O.J; et al. (1968) The abdominal
constriction response and its suppression by
analgesic drugs in the mouse. Br. J. Pharmac.
Chemother. 32, 295-310;
-
WHITTLE, B.A.
(1964) The use of changes in capillary
permeability in mice to distinguish between
narcotic and non narcotic analgesics. Br. J. Pharmac. Chemother., 22, 246-253.
2.
Teste da formalina
2.1 - Animais
Camundongos ou
ratos.
2.2 - Tipo de teste
Nocicepção
manifesta por injeção de agente algésico.
2.3 - Detalhamento do teste
|
 |
|
Vídeo
2: Demonstrativo do teste da formalina
(arquivo ASF, tamanho aproximado 700 KB) |
|
Camundongos
suíços de ambos os sexos deixados em jejum por
um período de 8 horas, ou ratos com peso entre
100 e 200 g, recebem administração subplantar
de 20 µl de uma solução de formalina 2,5% na
pata traseira. Uma hora antes da administração
da formalina drogas a serem testadas são
administradas por via oral na dose de 100 µmol/kg
numa suspensão com goma arábica 5%, podendo
ser administradas na pata dos animais em casos
nos quais têm-se a intenção de observar seu
efeito local. O tempo que o animal lambe,
sacode (comportamento conhecido como “flinch”)
ou morde a pata traseira é então cronometrado.
São observadas duas fases distintas. A
primeira fase (0-5 minutos pós-injeção) é
chamada de fase neurogênica, na qual
ocorre a ativação direta dos nociceptores
locais pela formalina, e a segunda (15-30
minutos após a injeção) é chamada de fase
inflamatória, na qual o comportamento
observado é resultante da ação de mediadores
inflamatórios liberados pelo estímulo.
Variações do
teste de formalina têm sido utilizadas na pata
dianteira ou mesmo na região da articulação
temporomandibular (ATM) de ratos.
2.4 - Bibliografia
-
HUNSKAAR S,
HOLE K. (1987) The formalin test in mice:
dissociation between inflammatory and
non-inflammatory pain. Pain. 30:103-14.
[Veja
artigo original]
-
PARADA CA,
TAMBELI CH, CUNHA FQ, FERREIRA SH. The
major role of peripheral release of
histamine and 5-hydroxytryptamine in
formalin-induced nociception.
Neuroscience. 2001;102(4):937-44.
[Veja
artigo original]
-
2.3) ROVERONI
RC, PARADA CA, CECILIA M, VEIGA FA, TAMBELI
CH. Development of a behavioral model of
TMJ pain in rats: the TMJ formalin test.
Pain. 2001 Nov;94(2):185-91.
[Veja
artigo original]
3.
Ensaio da placa quente
3.1 - Animais
Camundongos ou
ratos.
3.2 - Tipo de teste
Nocicepção térmica
manifesta por reflexo de retirada de pata.
3.3 - Detalhamento do teste
A atividade
analgésica central pode ser avaliada por meio
do teste da placa quente. Neste teste, o
equipamento, que consiste de uma placa de
metal, é aquecido até a temperatura de 55 (±1)
°C. Embora KURAISHI et al (1983) tenha
descrito primeiramente o teste para uso em
camundongos, muitos experimentos são feitos
com ratos. Originalmente, camundongos suíços
de ambos os sexos, com pesos entre 18 e 25g,
são colocados sobre a placa aquecida e, as
respostas ao estímulo térmico (retirada e
lambida das patas traseiras ou dianteiras),
cronometradas.
São feitas duas
medidas-controle em intervalos de 30 minutos.
Por meio dessas medidas se estabelece o tempo
de “cut-off”, ou seja, o tempo máximo
de permanência do animal sobre a placa,
calculado como sendo aproximadamente 3 vezes o
valor médio da 2ª medida-controle. Adotou-se,
porém, um cut-off de 25 segundos devido
a possíveis lesões que poderiam ser causadas
na pata do animal pela exposição a tempos
superiores.
A primeira
leitura-controle tem o objetivo de adaptação
dos animais ao ensaio. A segunda
leitura-controle é utilizada para exclusão do
ensaio dos animais que possuem período de
latência superior a 9,9s, sendo considerada
como a resposta-controle do tempo zero.
Os compostos são
administrados em seguida à segunda
leitura-controle, geralmente, por via oral,
embora outra via de administração possa ser
utilizada.
As medidas do
tempo de resposta são registradas em
intervalos de 30 minutos após a administração
durante 2 horas (tempos: 30 min; 60 min; 90
min; 120 min). Os resultados são expressos em
média ± EPM dos tempos registrados nos lotes
de animais.
3.4 - Bibliografia
4.
Teste de retirada da cauda (Tail Flick test)
4.1 - Animais
Camundongos ou
ratos.
4.2 - Tipo de teste
Nocicepção térmica
manifesta por reflexo de retirada de cauda.
4.3 - Detalhamento do teste
A analgesia
promovida pelo sistema nervoso central também
pode ser avaliada por meio do teste de tail
flick, ou retirada de cauda. Este teste
pode ser realizado tanto com camundongos
quanto com ratos. De acordo com KURAISHI et al
(1983), camundongos suíços de ambos os sexos
com pesos entre 18 e 25g, mantidos em jejum
por um período de 8 h, ou ratos pesando entre
100 e 200 g, são colocados no aparelho com a
cauda sobre a lâmpada (intensidade 9 no
aparelho analgesy meter, modelo 7106 da
Leticaä)
e o tempo que os animais levam para retirar a
cauda após a aplicação do estímulo térmico é
cronometrado.
Da mesma maneira
que o teste anterior (hot plate), são
feitas duas medidas-controle em intervalos de
30 minutos. Por meio dessas medidas se
estabelece o tempo de “cut-off” (máximo
de permanência da cauda sobre a lâmpada),
calculado como sendo de aproximadamente 3
vezes o valor médio da 2ª medida-controle.
Adotou-se, porém, um cut-off de 15s,
devido a lesões causadas na cauda quando
exposta a um tempo superior a este.
A primeira
leitura-controle tem o objetivo de adaptação
dos animais ao ensaio. A segunda
leitura-controle é utilizada para exclusão do
ensaio animais que possuem período de latência
superior a 7,9s, sendo considerada a
resposta-controle do tempo zero.
As drogas a
serem testadas são administradas em seguida à
segunda leitura-controle, geralmente por via
oral, podendo, contudo, ser utilizada outra
via de administração.
As medidas do
tempo de resposta são registradas em
intervalos de 30 minutos após a administração,
durante 2 horas (tempos: 30min; 60min; 90min;
120min). Os resultados são expressos em média
+ EPM dos tempos registrados nos lotes
de animais.
4.4 - Bibliografia
5. Teste da placa quente modificado
5.1 - Animais
Ratos.
5.2 - Tipo de teste
Nocicepção térmica
manifesta por reflexo de retirada da pata.
5.3 - Detalhamento do teste
Ratos Wistar
pesando 120-200g são colocados individualmente
no equipamento que consiste de uma placa
quente com temperatura ajustada em 51ºC. A
latência da resposta de retirada da pata
traseira esquerda é determinada 0, 30, 60,
120, 180, e 240 min após a administração do
estímulo hiperalgésico, que pode ser feita por
diversas vias de administração (intraplantar,
intratecal, via oral, etc). O tempo máximo
permitido para permanência dos animais na
superfície quente é 20s. Os experimentos devem
ser feitos em ambiente sem barulho e com ar
condicionado (20-22ºC).
A sensibilidade
ao calor (hiperalgesia térmica) é definida
como o decréscimo no tempo de retirada da pata
e calculada como a seguir: Δ latência de
retirada de pata (s) = (latência de retirada
de pata esquerda no tempo 0) – (latência de
retirada de pata esquerda nos demais tempos).
5.4 - Bibliografia
-
LAVICH, T.R.
et al. (2003) Combined action of vasoactive
amines and bradykinin mediates
allergen-evoked thermal hyperalgesia in rats. Eur J of Pharmacol. 61039, 1-8;
[Veja
artigo original]
-
LAVICH, T.R.
et al. (2005) A novel hot-plate test
sensitive to hyperalgesic stimuli and
non-opioid analgesics. Brazilian Journal of
Medical and Biological Research, 38, 445 –
451.
[Veja
artigo original]
6.
Teste de Randall & Selitto
6.1 - Animais
Ratos.
6.2 - Tipo de teste
Hiperalgesia por
pressão crescente na pata de ratos.
6.3 - Detalhamento do teste
O teste
comportamental de Randall & Selitto (1957) é um
método para avaliação da hipernocicepção
bastante utilizado. Para a execução deste teste
utiliza-se equipamento apropriado denominado
analgesímetro (Ugo-Basile, Stoelting, Chicago,
IL), que gera aumento linear da força (em
gramas) sobre a superfície dorsal da pata do
animal, até que o mesmo produza uma resposta
caracterizada pela retirada da pata. O reflexo
de retirada da pata é considerado representativo
do limiar hipernociceptivo, ou seja, a força
necessária aplicada à pata para que induza uma
resposta aversiva a um estímulo nocivo (Limiar
Nociceptivo de Retirada da Pata - LNRP). A força
necessária para que esse animal exiba tal
resposta é registrada em gramas. O LNRP é
avaliado antes e após a administração dos
estímulos hiperalgésicos ou inflamatórios, que
variam de acordo com o experimento. Para reduzir
o stress, os ratos devem ser habituados ao
equipamento 1 dia antes da execução do
experimentos.
6.4 - Bibliografia
7.
Teste de pressão crescente na pata de ratos (von Frey
eletrônico)
7.1 - Animais
Ratos, embora o
teste também possa ser realizado em camundongos.
7.2 - Tipo de teste
Hiperalgesia por
pressão crescente na pata de ratos.
7.3 - Detalhamento do teste
|
 |
|
Vídeo 3: Demonstrativo do teste de
pressão
crescente na pata de ratos
(arquivo MPEG, tamanho aproximado
2MB) |
|
O uso de
filamentos de von Frey (von Frey, 1896) é um
método para avaliar a sensibilidade tecidual
ao estímulo mecânico bastante utilizado
clinicamente. Entretanto, tal método passou a
ser utilizado também para experimentos
laboratoriais, no sentido de avaliar a
influência de drogas sobre a sensibilidade
nociceptiva em animais. Mais ainda, essa
técnica foi transformada em um método
eletrônico usado primeiramente em humanos (JENSEN
et al., 1986) e posteriormente em ratos (MÖLLER
et al., 1998).
Os experimentos
são realizados com um anestesiômetro
eletrônico (Modelo 1601C, Life Sciences
Instruments, Califórnia, EUA), que consiste em
um transdutor de pressão conectado a um
contador digital de força expressa em gramas
(g). A precisão do aparelho é de 0,1 g. O
aparelho é calibrado para registrar uma força
máxima de 150 g, mantendo a precisão de 0,1 g
até a força de 80 g. O contato do transdutor
de pressão à pata dos animais é realizado por
meio de uma ponteira descartável de
polipropileno com 0.5 mm de diâmetro adaptada
a este. Os animais (ratos ou camundongos) são
colocados em caixas de acrílico, cujo assoalho
é uma rede de malha igual a 5 mm2 constituída
de arame não maleável de 1 mm de espessura,
durante 15 minutos antes do experimento para
adaptação ao ambiente. Espelhos são
posicionados 25 cm abaixo das caixas de
experimentação para facilitar a visualização
das plantas das patas dos animais. O
experimentador deve aplicar, por entre as
malhas da rede, uma pressão linearmente
crescente no centro da planta da pata do rato
ou camundongo até que o animal produza uma
resposta caracterizada como sacudida (“flinch”)
da pata estimulada. Os estímulos são repetidos
por até seis vezes, em geral até o animal
apresentar três medidas similares com uma
clara resposta de “flinch” após a
retirada da pata. A intensidade de
hipernocicepção é quantificada como a variação
na pressão (D
de reação em gramas) obtida subtraindo-se a
média de três valores expressos em gramas
(força) observada antes do procedimento
experimental (0 hora) da média de três valores
em gramas (força) após a administração dos
estímulos que variam de acordo com o
experimento.
|
 |
|
Fig. 1:
Teste de pressão crescente na pata de
ratos (von Frey eletrônico) - Exemplo
1 |
|
|
 |
|
Fig. 2:
Teste de pressão crescente na pata
de ratos (von Frey eletrônico) -
Exemplo 2 |
|
7.4 - Bibliografia
-
JENSEN K,
ANDERSEN HO, OLESEN J, LINDBLOM U. (1986)
Pressure-pain threshold in human temporal
region. Evaluation of a new pressure
algometer. Pain. 25, 313-323.
[Veja
artigo original]
-
MOLLER KA,
JOHANSSON B, BERGE OG. (1998) Assessing
mechanical allodynia in the rat paw with a
new electronic algometer. J Neurosci
Methods, 84, 41-47.
[Veja
artigo original]
-
VIVANCOS GG,
VERRI WA JR, CUNHA TM, SCHIVO IR, PARADA CA,
CUNHA FQ, FERREIRA SH. An electronic
pressure-meter nociception paw test for rats.
Braz J Med Biol Res. 2004 Mar;37(3):391-9.
[Veja
artigo original]
-
CUNHA TM,
VERRI WA JR, VIVANCOS GG, MOREIRA IF, REIS
S, PARADA CA, CUNHA FQ, FERREIRA SH. An
electronic pressure-meter nociception paw
test for mice. Braz J Med Biol Res. 2004
Mar;37(3):401-7.
[Veja
artigo original]
8.
Teste de pressão constante na pata de ratos
8.1 - Animais
Ratos.
8.2 - Tipo de teste
Hiperalgesia por
pressão constante na pata de ratos.
8.3 - Detalhamento do teste
|
 |
|
Vídeo 4:
Demonstrativo do teste de pressão
constante na pata de ratos
(arquivo MPEG, tamanho aproximado 5,7
MB) |
|
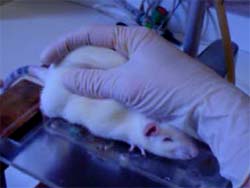
Nesta técnica,
primeiramente descrita por Randall & Selitto
(1957) e modificada por Ferreira et al., (1978),
o animal é colocado em uma plataforma e mantido
em decúbito ventral pela mão do experimentador.
Qualquer uma das patas traseiras é submetida à
pressão constante de 20 mmHg aplicada por um
pistão de diâmetro aproximado de 2 cm. A pressão
é interrompida quando o animal exibe reação
nociceptiva típica caracterizada por redução dos
movimentos de fuga, seguida de alterações na
freqüência respiratória e fasciculações no
dorso. A intensidade de hipernocicepção é
quantificada pela variação do tempo de reação em
segundos (D
do tempo de reação) obtida subtraindo-se o tempo
de reação observado antes do procedimento
experimental (0 hora) do tempo de reação após a
administração de substâncias que promovem
sensibilização dos nociceptores que variam de
acordo com o experimento.
8.4 Bibliografia
-
FERREIRA
SH, LORENZETTI BB, CORREA FM. (1978)
Central and peripheral antialgesic action of
aspirin-like drugs. Eur J Pharmacol. 53,
39-48.
[Veja
artigo original]
-
RANDALL LO,
SELITTO JJ. A method for measurement of
analgesic activity of inflamed tissue.
Arch Int Pharmacodyn, 1957;111:409-419.
[Veja
artigo original]
|
 |
|
Fig. 3:
Teste de pressão constante na pata de
ratos |
|
9.
Hiperalgesia
térmica por fonte de luz infravermelha na pata
traseira de rato (Teste de Hargreaves)
9.1 - Animais
Ratos.
9.2 - Tipo de teste
Hiperalgesia
térmica por aplicação de luz quente na pata de
ratos.
9.3 - Detalhamento do teste
|
 |
|
Vídeo
5: Demonstrativo do teste de Hargreaves
(arquivo MPEG, tamanho aproximado 5,5 MB) |
|
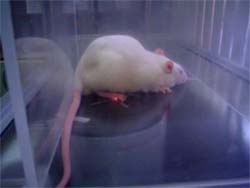
O teste de
Hargreaves foi descrito 1988 e consiste no
aquecimento, por meio de uma fonte radiante de
luz infravermelha, da região central da planta
da pata traseira de ratos. O comportamento
nociceptivo é avaliado como a sensibilidade ao
calor (hipernocicepção térmica), determinada
pela latência de retirada da pata do raio de
luz. Contudo, o limite máximo permitido para
exposição da pata ao raio infravermelho é 15
segundos, no sentido de evitar danos
teciduais.
Os animais são
colocados em compartimentos de acrílico
individuais posicionados sobre uma superfície
de vidro especial, que permite a passagem de
forma homogênea da luz e do calor. Cinco
minutos são utilizados para adaptação dos
animais ao ambiente. Após esse período, a
fonte de luz infravermelho, colocada sob cada
uma das patas traseiras do animal, é acionada
juntamente com um cronômetro eletrônico, até
que o animal retire a pata e, a fonte de luz e
o relógio parem automaticamente.
Duas ou três
medidas são realizadas com um intervalo de
tempo de 5 a 10 minutos entre as mesmas. As
medidas de latência de retirada da pata são
expressas como avaliações percentuais
relativas às patas-controle (contralaterais)
em cada tempo de observação.
9.4 Bibliografia
-
HARGREAVES K,
DUBNER R, BROWN F, FLORES C, JORIS J. A
new and sensitive method for measuring
thermal nociception in cutaneous
hyperalgesia. Pain. 1988 Jan;32(1):77-88.
[Veja
artigo original]

